
Популярное

Проскок электрона
Ранее мы разобрали порядок заполнения энергетических уровней и выяснили, что электроны не перейдут на следующий подуровень, пока не заполнят предыдущий до конца (принцип Гунда). Однако, иногда, данное правило будет нарушаться в связи с тем, что эти отступления от общей последовательности будут обеспечивать электрону меньшую энергию. Дело в том, что атомы стремятся полностью или наполовину заполнить подуровень (, ), поэтому когда в атомах элементов строение электронной оболочки приближается к вышеуказанному, может наблюдаться преждевременное заполнение -подуровня за счёт проскока электрона с внешнего - подуровня на предвнешний -подуровень.

Периодическая система химических элементов Д.И. Менделеева
Итак, таблица Менделеева – это кладезь информации о строении веществ, которую, тем не менее нужно уметь получать. На самом экзамене будет выдан материал примерно следующего содержания: По вертикали располагаются группы, которые делятся на подгруппы: основная и побочная, а по горизонтали – периоды, которые тоже делятся: на малые – это первые 3 и большие – все остальные. У каждого элемента подписаны номер и относительная атомная масса, условная единица массы – масса одного протона или нейтрона.
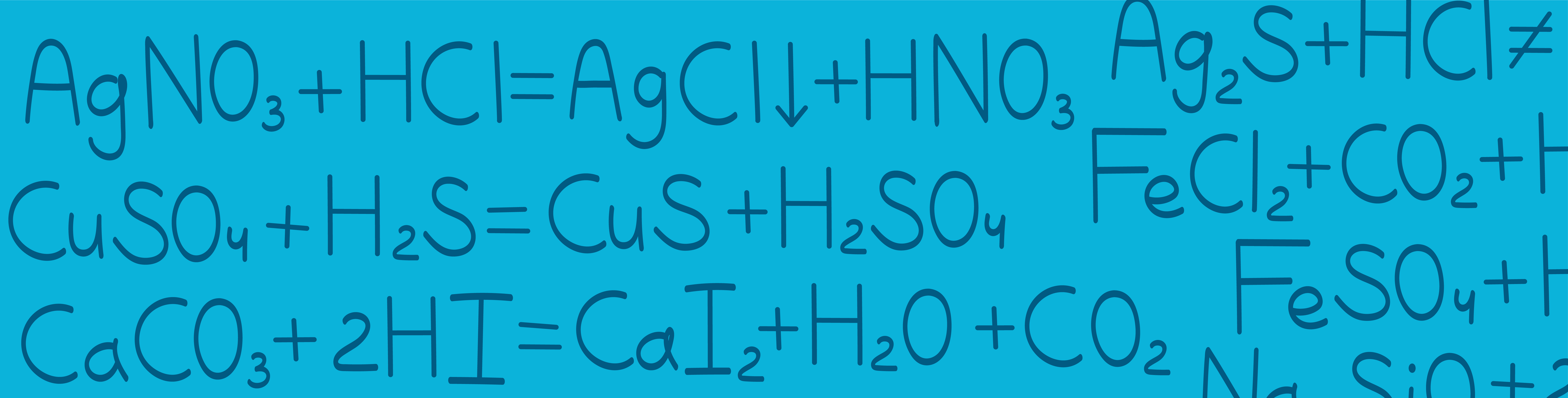
Реакции кислот с солями
Условия, при которых кислота реагирует с солью, являются одними из самых сложных для понимания. Зная эту тему, можно заработать баллы в 6, 7, 8, 9, 30, 32 заданиях ЕГЭ в соответствии с критерями. Для этого нужно безошибочно определять, когда идет реакция, а когда она невозможна. Кислота + соль = кислота + соль

Возбужденное состояние атомов
Ранее мы с вами прошли электронные оболочки атома и электронную конфигурацию. Давайте вспомним электронную конфигурацию хлора: Данная электронная конфигурация отражает основное состояние хлора. В этом состоянии у хлора один неспаренный электрон, значит, он может образовать только одну связь по обменному механизму, то есть иметь валентность I, например, в : Но у хлора может быть валентность не только I, но еще и III (), V (), и даже VII (). Как такое возможно? Дело в том, что атомы могут переходить в так называемое возбужденное состояние, при котором их электронные пары распариваются и электроны занимают свободные орбитали на этом же уровне. А где взять эти свободные орбитали? Давайте вспомним, что хлор находится в 3 периоде, а это значит, что на внешнем слое у него 3 подуровня: , и . Да, в основном состоянии -подуровень у хлора не заполнен, но это не значит, что его не существует. Если атому хлора в основном состоянии сообщить энергию извне, он перейдёт в первое возбужденное состояние, при котором одна электронная пара распаривается: В данном состоянии у Хлора три неспаренных электрона, а значит валентность равна III. Второе возбужденное состояние хлора будет выглядеть так: Валентность Хлора в нем равна V. Третье возбужденное состояние Хлора: Теперь валентность хлора стала равна VII. Больше в возбужденное состояние он переходить не может, так как на внешнем уровне закончились неспаренные электроны. Поэтому данная валентность будет называться высшей (равна номеру группы). Однако 3 элемента не могут переходить в возбужденное состояние, соответственно, и иметь валентность равную номеру группы. Эти элементы – азот, кислород и фтор. Они находятся во втором периоде, значит, на внешнем слое 2 подуровня ( и ) и свободных орбиталей для распаривания электронной пары у них нет: Азот: Кислород: Фтор:

Изменение свойств в периодах и группах
Утром 17 февраля 1868 года Дмитрий Иванович Менделеев схватил бумагу с ручкой и начал вырисовывать карточки известных элементов, пытаясь их как-то систематизировать по атомной массе и валентности. В тот день была создана первая современная версия «Периодической системы химических элементов». Вся гениальность этой таблицы в том, что химические свойства элементов повторяются в периодах и группах. Давайте разбираться. Период – это горизонтальный ряд химических элементов. Первые три периода называются малыми, так как состоят из одного ряда. Начиная с 4 периода прибавляется второй ряд элементов, а период уже носит название – большой. Группа – это вертикальный ряд химических элементов. Группа делится на подгруппы: главную и побочную. Главная подгруппа начинается сверху; побочная располагается с другого края группы. С тех пор стали известны разные свойства элементов. Все они подчиняются закону: «Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра».
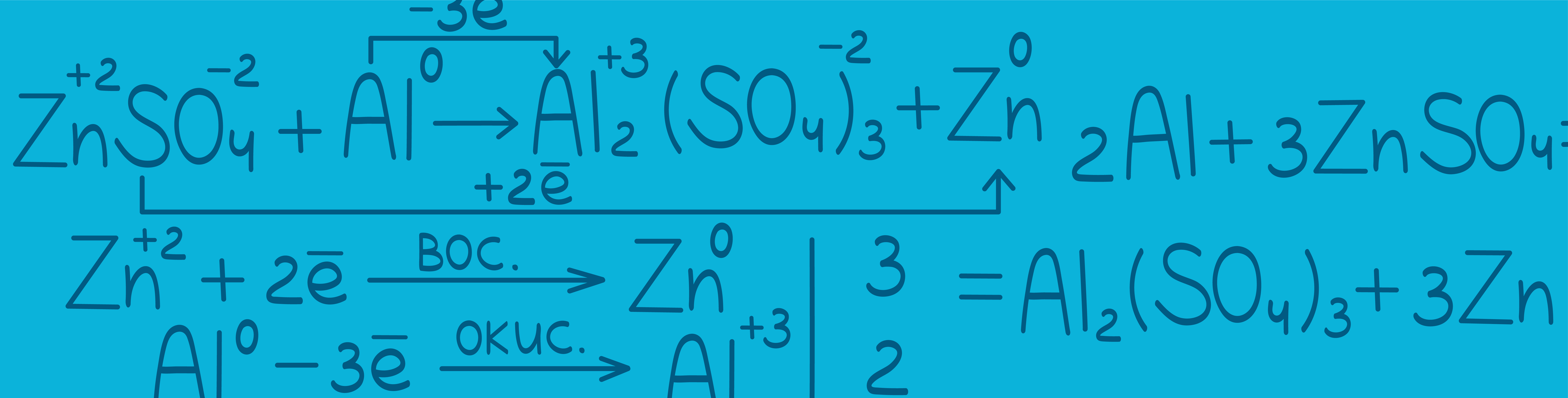
Окислительно-восстановительные реакции
Суть окислительно-восстановительной реакции заключается в обмене электронами: одни элементы их отдают, а другие — забирают, в результате чего и происходит изменение степени окисления этих элементов и образуются новые вещества. Элемент, который отдает электроны, называется восстановителем, а элемент, который эти электроны принимает — окислителем. Чтобы проще это было запомнить, предлагаю твоему вниманию такой интересный стишок: Окислитель — он грабитель. Электроны отбирает, карму (степень окисления) резко понижает. Восстановитель — он спаситель. Электроны отдает, карма (степень окисления) вверх его растет. Итак, мы делаем первый важный вывод: ОВР — это реакция между окислителем и восстановителем. Составление ОВР происходит в 3 этапа: выбор реагентов: окислителя, восстановителя и среды, если она необходима; написание продуктов реакции; расставление коэффициентов (уравнивание).
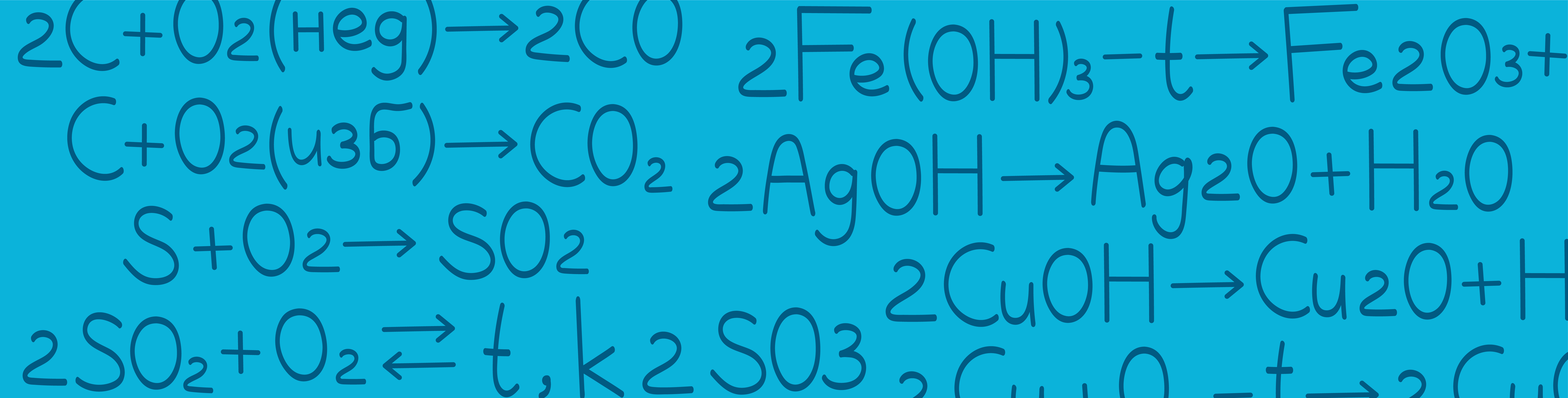
Основные способы получения оксидов
Окисление кислородом неметаллов с получением кислотных и несолеобразующих оксидов. При взаимодействии неметалла с избытком кислорода образуется оксид в высшей степени окисления неметалла, а в случае недостатка кислорода степень окисления будет промежуточной. Например: Однако сера всегда окисляется до промежуточной степени окисления (+4). Для дальнейшего окисления требуется катализатор (V2O5) и нагревание: В случае азота протекает обратимый процесс образования оксида азота (II) при нагревании до 3000 °C. Но помните, что таким способом нельзя получить оксиды галогенов. Окисление кислородом металлов с получением основных и амфотерных оксидов. С кислородом не образуют оксид: натрий (образует пероксид) и калий, рубидий, цезий, франций (образуют надпероксид). Никогда не реагируют с кислородом золото, платина и палладий. Окисление кислородом сложных веществ. Летучие водородные соединения неметаллов сгорают в кислороде с образованием оксида и воды: однако в присутствии катализатора реакция протекает с образованием других продуктов: Большинство сульфидов окисляются кислородом с образованием двух оксидов: Сильные кислоты-оксилители в реакциях с металлами и неметаллами образуют оксиды: Реакции образования малодиссоциирующих веществ также приводят к получению газообразного оксида. Окисление озоном простых и сложных веществ. Озон является более сильным окислителем, чем кислород. В связи с этим он способен окислять многие вещества и без нагревания.
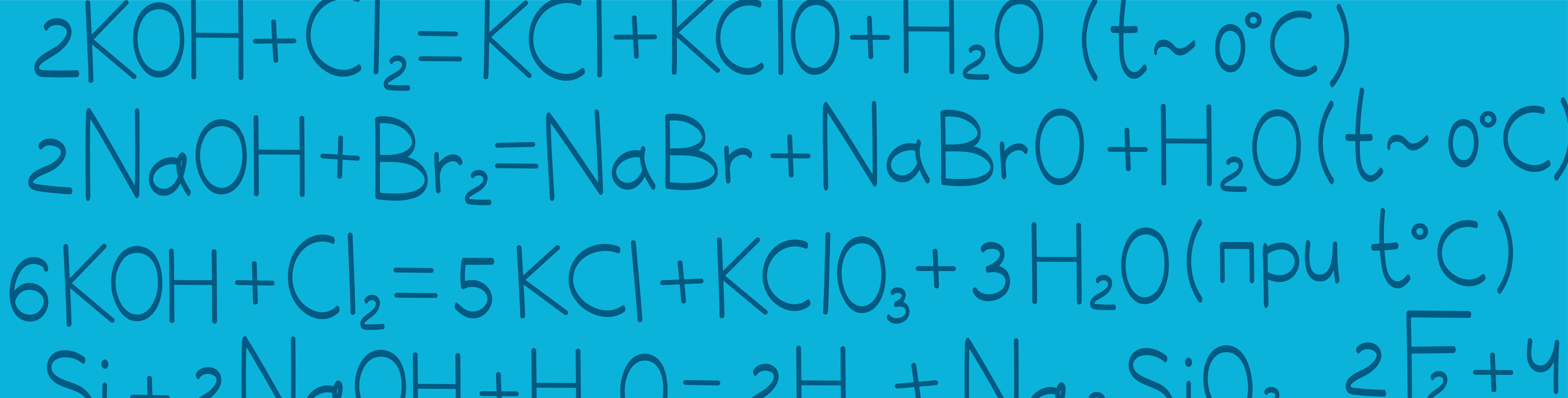
Неметаллы с щелочами
Знание того, как разные неметаллы ведут себя с щелочами, поможет при решении заданий на соответствие в 1 части и написании реакций из 2 части ЕГЭ по химии. Каждый неметалл ведет себя с щелочами по-разному: – не реагируют с щелочами; – диспропорционируют.

Степень окисления
Для того, чтобы решить задание №3, нам нужно разбираться в понятиях «валентность», «степень окисления», и не путать их. Итак, начнем с самого начала: Связь между атомами образуется за счет образования общей электронной пары. Электроны имеют отрицательный заряд. Все элементы в таблице Менделеева имеют разную электроотрицательность (способность притягивать электроны). Когда образуется связь, какой-то из элементов сильнее притягивает электрон (несколько электронов), и его заряд становится отрицательным. А у атома, от которого этот электрон улетает, заряд становится положительным. Например, NaCl: у хлора электроотрицательность больше, чем у натрия, поэтому он перетягивает электрон натрия и приобретает отрицательный заряд, а натрий – положительный. Степень окисления — это условный заряд атома элемента в соединении. Она обозначается латинскими цифрами и всегда имеет знак (+2, -3, +7). При этом очень важно сначала ставить знак, а потом цифру, например, . Как и с валентностью, есть элементы с постоянной степенью окисления, а есть с переменной. Мы также должны запомнить список первых, хотя он и становится немного шире: Как и валентность, степень окисления бывает высшая, низшая и промежуточная. Высшая степень окисления равна номеру группы со знаком «плюс». Низшая определяется по формуле: № группы – 8. И промежуточная степень окисления — это все, что между ними. С первого взгляда может показаться, что валентность и степень окисления целочисленно равны. Например, Na: валентность – I, степень окисления – +1. Но степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе равна I, а степень окисления – 0. В двойных оксидах у атома две степени окисления. Например, в железной окалине у железа две степени окисления: +2 и +3.. В пероксидах степень окисления атомов кислорода, равна –1, а валентность – 2. ().
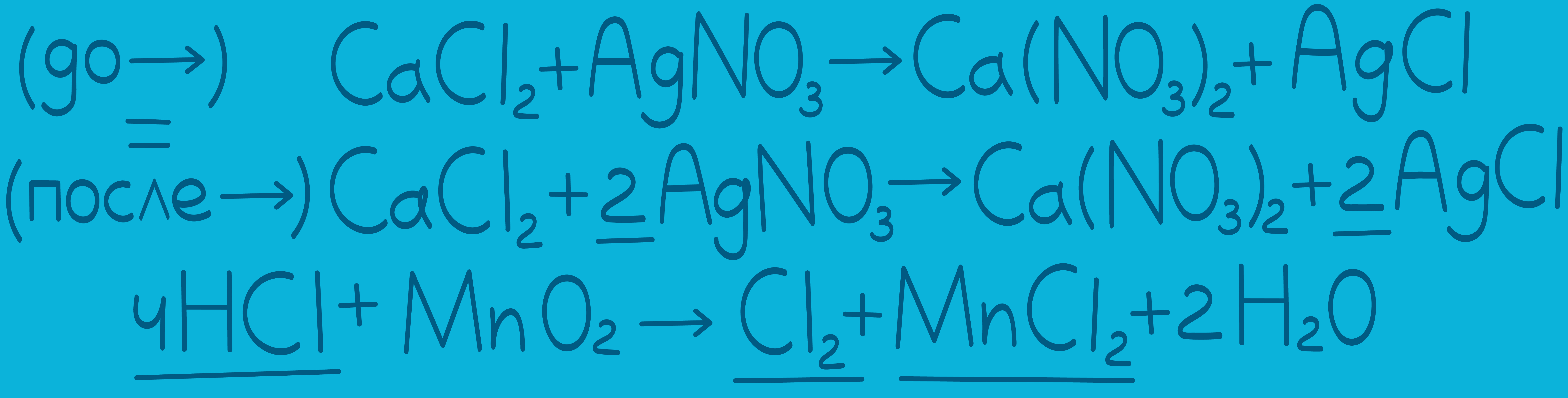
Как уравнивать реакции ионного обмена
Химические реакции – это то, с чем сталкивается любой школьник, который сдает ЕГЭ по химии. И справляться с ними достаточно легко, если знать несколько важных правил. В этой статье мы разберем основную теорию, необходимую тебе для решения задач и получения заветных баллов. Химическая реакция – превращение одного или нескольких веществ в другие вещества. Давай на нее посмотрим: В записи уравнения реакции мы видим маленькие цифры и большие. маленькие цифры называются индексами. Они относятся к самим веществам, отображая их молекулярную формулу, поэтому при уравнивании мы их трогать не будем; большие цифры, которые стоят впереди веществ – это коэффициенты. Именно их мы будем ставить при уравнивании. Отсутствие коэффициента означает коэффициент 1. Реакция считается уравненной, если количество элементов слева (до →) равно количеству элементов справа (после →). Давай проверим нашу реакцию, посчитав, например, атомы хлора: слева в реакции 4 атома хлора () и справа тоже 4 ( и ). То же самое можно сказать и про остальные атомы, значит эта реакция уравнена. Таким образом, уравнивание – это расстановка коэффициентов для того, чтобы уравнять атомы до и после реакции (слева и справа).

Основания: классификация, номенклатура, физические свойства и способы применения
Основания – это химические вещества, которые обладают способностью принимать протоны от кислот и образовывать ионы гидроксида (OH-). Основаниями являются гидроксиды металлов со степенями окисления «+1» и «+2», кроме . Они являются одной из основных групп химических соединений и находят широкое применение в различных областях науки и техники. I. Классификация оснований Классификация оснований основывается на их растворимости и устойчивости. Поделить основания можно на три группы: Растворимые в воде – щелочи. Это сильные основания, образованные металлами IA и IIA (начиная с Са) группы. Их всего 10 (LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2. Неустойчивые основания. Они являются слабыми основаниями, самопроизвольно разлагаются и не почти существуют в свободном виде. К ним относятся: NH4OH, AgOH, CuOH и Hg(OH)2. Подробные схемы разложения данных оснований представлены ниже на фото. Нерастворимые в воде основания. Все остальные гидроксиды металлов со степенями окисления окисления «+1» и «+2», кроме Be(OH)2, Zn(OH)2, Pb(OH)2 и Sn(OH)2. Они являются слабыми основаниями. Например, Fe(OH)2, Mg(OH)2

Изменение свойств в таблице Менделеева
Утром 17 февраля 1868 года Дмитрий Иванович Менделеев схватил бумагу с ручкой и начал вырисовывать карточки известных элементов, пытаясь их как-то систематизировать по атомной массе и валентности. В тот день была создана первая современная версия «Периодической системы химических элементов». Вся гениальность этой таблицы в том, что химические свойства элементов повторяются в периодах и группах. Давайте разбираться. Период – это горизонтальный ряд химических элементов. Первые три периода называются малыми, так как состоят из одного ряда. Начиная с 4 периода прибавляется второй ряд элементов, а период уже носит название – большой. Группа – это вертикальный ряд химических элементов. Группа делится на подгруппы: главную и побочную . Главная подгруппа начинается сверху; побочная располагается с другого края группы. С тех пор стали известны разные свойства элементов. Все они подчиняются закону: «Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра».

Валентность
Наш мир так многообразен, потому что химические элементы способны образовывать соединения посредством связей. В свою очередь химия связь зависит от степени валентности. Поэтому разбираемся, что это и как поможет нам на экзамене. Валентность — это возможность атомов образовывать химические связи с другими атомами. Она обозначается римскими цифрами (I, II, III, IV и т.д.) Есть элементы, у которых только одна валентность. Например, Кальций: его постоянная валентность, равная II, а это значит, что он может образовывать две связи: Но большинство элементов в разных соединениях проявляют разную валентность. Например, сера. У нее может быть валентность II, IV, VI: В таком случае различают низшую валентность ― минимальное число связей, которые может образовать элемент, промежуточную, и высшую (максимальное число связей). Для серы минимальная валентность – II, максимальная - VI. Как же определить, у каких элементов постоянная валентность, а у каких – переменная? Для этого есть таблица, в которой собраны все элементы с постоянной валентностью, у всех остальных – переменная. Теперь разбираемся с элементами, у которых может быть несколько валентностей: Для этих элементов (за исключением кислорода, азота и фтора (см. тему "Возбужденное состояние") высшая валентность равна номеру группы. Низшая валентность вычисляется по формуле: № группы – 8 Валентность между высшей и низшей называется промежуточной. Разберем на примере брома: Бром находится в VII группе, значит его высшая валентность равна VII. Считаем низшую валентность: № группы – 8 = 7 – 8 = –1. Валентность – это количество связей, поэтому она не может быть отрицательной, соответственно низшая валентность брома равна I. Промежуточная валентность брома – III, V (см. тему «Возбужденное состояние»).
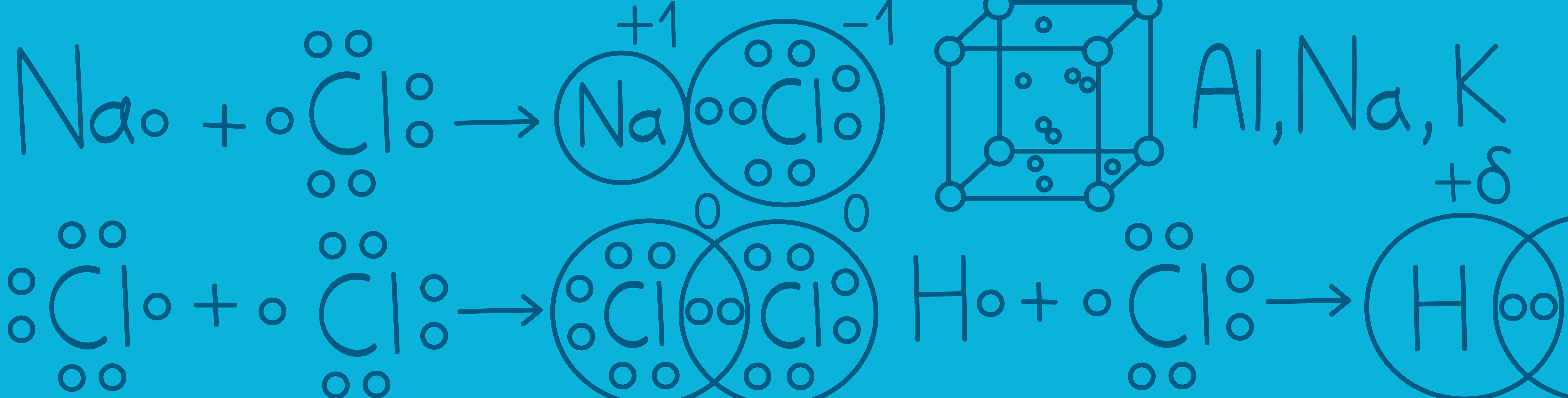
Типы химической связи
Итак, все вокруг состоит из атомов. Атомы взаимодействуют друг с другом посредством образования химических связей (электронной пары). Давайте подробнее разберем виды связи и механизм их образования. Все элементы в таблице Менделеева можно разделить на металлы и неметаллы. Атомы отличаются друг от друга электроотрицательностью – способностью атомов перетягивать на себя общую электронную пару. У неметаллов электроотрицательность выше, самый ЭО элемент – это фтор. Таким образом, когда образуется соединение из нескольких атомов, кто-то перетягивает электронную пару на себя сильнее. При образовании соединения возможны несколько вариантов взаимодействия: Неметалл₁ + неметалл₂ () Неметалл₁ + неметалл₁ () Металл + неметалл () Металл₁ + металл₁ ()

Задание №23 ЕГЭ
С 2022 года в ЕГЭ по химии появляется новое задание на химическое равновесие. Оно предполагает умение анализировать таблицы и применять знания из области неорганики и общей химии. Разберем алгоритм его решения на примере одного номера.
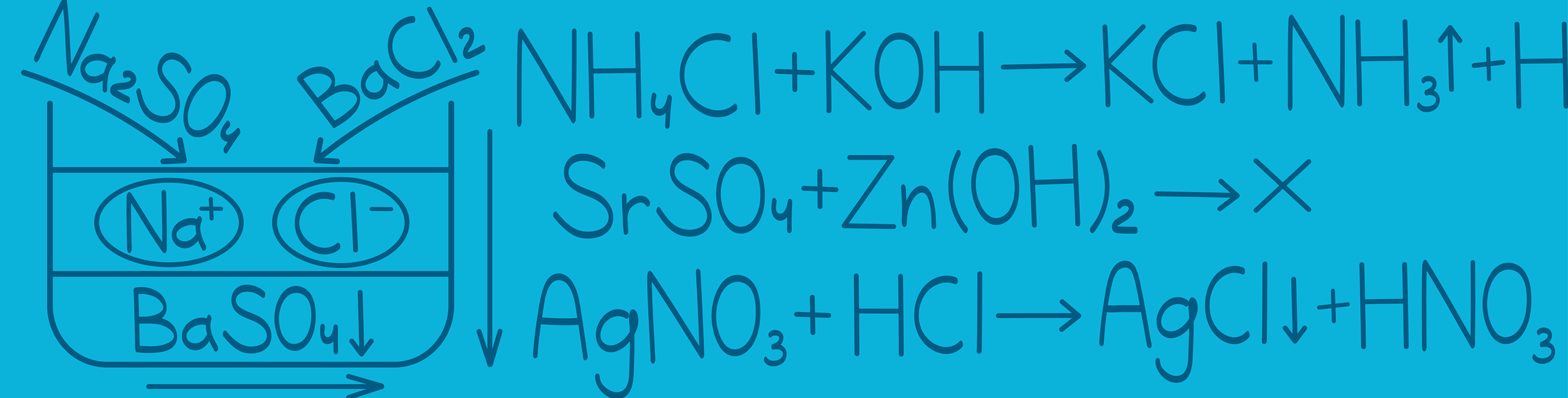
Реакции ионного обмена
Электролиты — это вещества, которые распадаются на ионы в растворе или расплаве. Неэлектролиты — это вещества, которые на ионы не распадаются. Например, если мы поместим в раствор сильный электролит — хлорид натрия, он распадается на ионы натрия и ионы хлора, которые теперь уже будут плавать отдельно. Сильный электролит распался на ионы в растворе. Если следом мы добавим в этот раствор другой сильный электролит — нитрат серебра, ионы двух солей будут взаимодействовать друг с другом, образуя две новые соли: нитрат натрия: сильный электролит и распадается на ионы; хлорид серебра: неэлектролит и на ионы не распадается, образуя целую молекулу. В результате РИО образовался неэлектролит — соль Только что мы с тобой описали классическую реакцию ионного обмена, а теперь давай разбираться подробнее.

Как уравнивать окислительно-восстановительные реакции
Если ты готовишься к ЕГЭ и ОГЭ по химии, то точно сталкивался с окислительно восстановительными реакциями. Это такие реакции, в которых происходит изменение степеней окисления атомов, входящих в состав молекул реагирующих веществ. Давай разберемся, какие навыки в решении заданий с окислительно-восстановительными реакциями тебе понадобятся, чтобы получить максимум баллов на экзамене. Для того, чтобы научиться уравнивать ОВР, мы перенесемся в мир окислителей-грабителей и восстановителей-спасителей. Вся суть ОВР помещается в один легко запоминающийся стишок: Окислитель — он грабитель. Электроны отбирает, карму (степень окисления) резко понижает. Восстановитель — он спаситель. Электроны отдает, карма вверх его растет. То есть после реакции у элемента-окислителя увеличивается количество электронов, а у элемента-восстановителя уменьшается. Электроны заряжены отрицательно, поэтому окислитель свою степень окисления понижает, а восстановитель повышает. Окислитель в реакции может забрать только определенное количество электронов, а восстановитель отдает тоже их фиксированное количество. И не всегда эти значения совпадают. Однако электроны не могут испариться в воздухе или появиться из ниоткуда, поэтому наша задача при уравнивании ОВР сводится к тому, чтобы уравнять количество отданных и принятых электронов.

Атом. Таблица Менделеева
Из атомов состоит всё, что нас окружает. Основные характеристики атомов записаны в таблице Менделеева. Давайте разберемся, что они обозначают. Атом состоит из ядра и электронных оболочек. Он заряжен нейтрально.
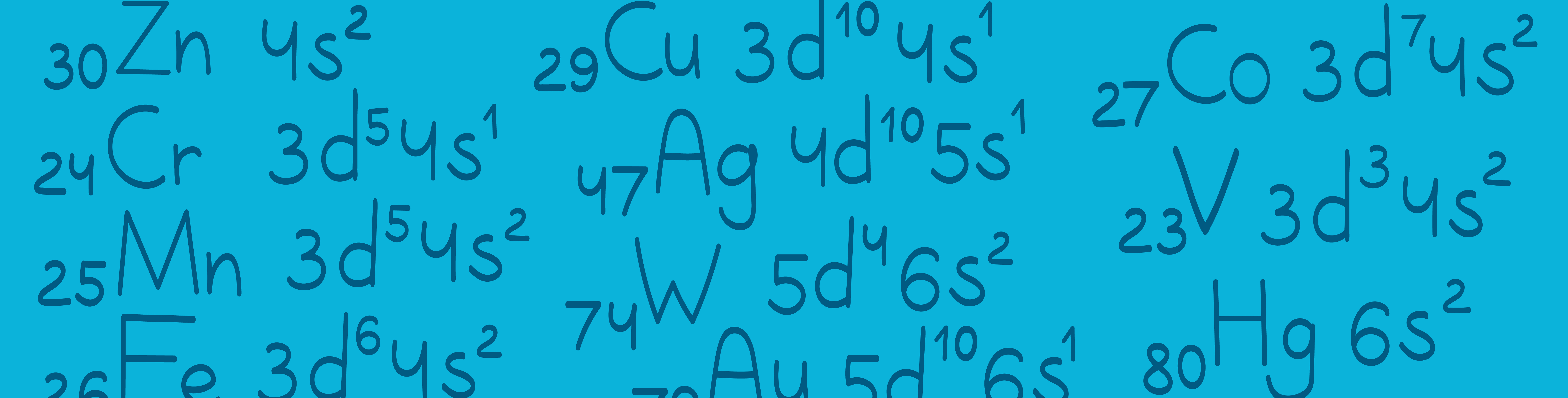
Переходные элементы
Есть несколько элементов, электронная конфигурация которых отличается от общепринятой. В 1 задании иногда попадаются эти элементы, давайте разберем их особенности: Вспомним основные тезисы по теме "конфигурация атома": Электроны располагаются вокруг ядра уровнями. Количество уровней равно номеру периода. Период – это горизонтальный столбец. Внутри каждого уровня есть подуровни, которые называются орбиталями. На первом уровне только -орбиталь. На втором – и на третьем – , , Группа – это вертикальный ряд химических элементов. Она делится на главную и побочную подгруппы. Главная подгруппа начинается сверху, а побочная располагается с другого края группы. И вот тут возникает вопрос: чем отличаются элементы главной и побочной подгруппы, почему одни находятся справа, а другие – слева? Давайте рассмотрим электронную конфигурацию титана: Порядковый номер этого элемента – 22, значит у него 22 электрона. И теперь заполняем энергетические уровни согласно принципу наименьшей энергии: Далее рассмотрим, как заполняются эти уровни в таблице Менделеева: У Титана электронная конфигурация заканчивается на -подуровне, поэтому в таблице Менделеева он находится в побочной подгруппе и называется переходным элементом. Можем сделать вывод:

Окислительно-восстановительные реакции. Написание продуктов и уравнивание
Продукты реакции складываются из: того, во что превратился окислитель того, во что превратился восстановитель побочных продуктов Ниже я хочу поделиться с тобой подробной и понятной схемой, куда превращаются окислители и восстановители: Куда превращаются окислители: Куда превращаются восстановители: Пользуясь этой схемой ты сможешь предугадывать основные продукты окислительно-восстановительных реакций. В курсе «неорганика» мы разбираем все нюансы, которых нет в этой таблице.

| МГ | Pro | ProMax | |
| Практика на платформе | |||
| Отслеживание прогресса обучения | |||
| Двухуровневое домашнее задание после каждого вебинара | |||
| Все материалы составлены экспертом ЕГЭ | |||
| Персональный менеджер | |||
| Личный куратор | |||
| Разбор ошибок личным куратором | |||
| Еженедельные созвоны с куратором для закрытия индивидуальных пробелов | |||
| Составление индивидуального расписания |

счёта
средств
подтверждено!
Теперь вы можете приступить
к следующему уроку
курса по математике
замены
Для смены номера телефона
мы отправили Вам код по СМС,
введите его в поле ниже.
Электронная почта
На почту придет чек об оплатеНажимая кнопку "купить", Вы выражаете своё согласие с офертой оказания услуг и принимаете их условия
Здравствуйте!
Выберите информацию о себе ниже

Оплата прошла успешно!





