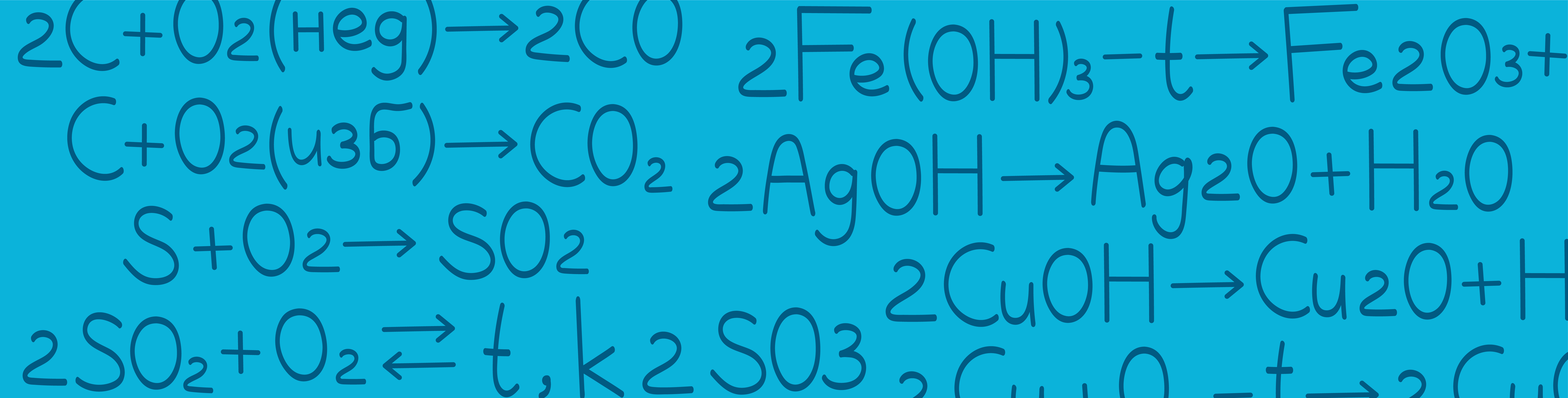Окисление кислородом неметаллов с получением кислотных и несолеобразующих оксидов.
При взаимодействии неметалла с избытком кислорода образуется оксид в высшей степени окисления неметалла, а в случае недостатка кислорода степень окисления будет промежуточной. Например:
Однако сера всегда окисляется до промежуточной степени окисления (+4).
Для дальнейшего окисления требуется катализатор (V2O5) и нагревание:
В случае азота протекает обратимый процесс образования оксида азота (II) при нагревании до 3000 °C.
Но помните, что таким способом нельзя получить оксиды галогенов.
Окисление кислородом металлов с получением основных и амфотерных оксидов.
С кислородом не образуют оксид: натрий (образует пероксид) и калий, рубидий, цезий, франций (образуют надпероксид). Никогда не реагируют с кислородом золото, платина и палладий.
Окисление кислородом сложных веществ.
Летучие водородные соединения неметаллов сгорают в кислороде с образованием оксида и воды:
однако в присутствии катализатора реакция протекает с образованием других продуктов:
Большинство сульфидов окисляются кислородом с образованием двух оксидов:
Сильные кислоты-оксилители в реакциях с металлами и неметаллами образуют оксиды:
Реакции образования малодиссоциирующих веществ также приводят к получению газообразного оксида.
Окисление озоном простых и сложных веществ.
Озон является более сильным окислителем, чем кислород. В связи с этим он способен окислять многие вещества и без нагревания.