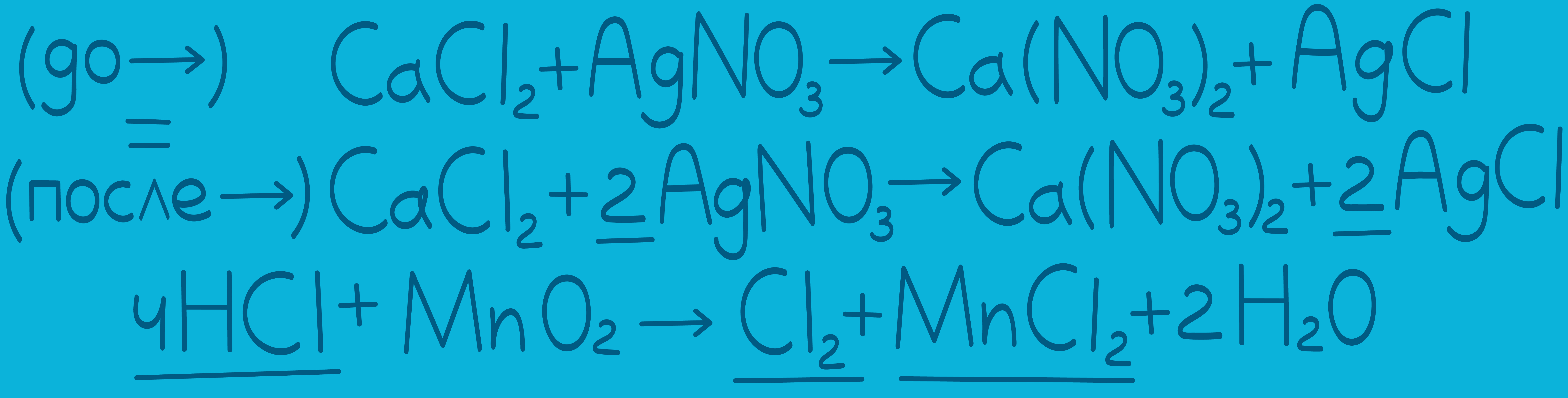Химические реакции – это то, с чем сталкивается любой школьник, который сдает ЕГЭ по химии. И справляться с ними достаточно легко, если знать несколько важных правил. В этой статье мы разберем основную теорию, необходимую тебе для решения задач и получения заветных баллов.
| Химическая реакция – превращение одного или нескольких веществ в другие вещества. |
Давай на нее посмотрим:

В записи уравнения реакции мы видим маленькие цифры и большие.
-
маленькие цифры называются индексами. Они относятся к самим веществам, отображая их молекулярную формулу, поэтому при уравнивании мы их трогать не будем;
-
большие цифры, которые стоят впереди веществ – это коэффициенты. Именно их мы будем ставить при уравнивании. Отсутствие коэффициента означает коэффициент 1.
Реакция считается уравненной, если количество элементов слева (до →) равно количеству элементов справа (после →).
Давай проверим нашу реакцию, посчитав, например, атомы хлора: слева в реакции 4 атома хлора ( ) и справа тоже 4 (
) и справа тоже 4 ( и
и  ). То же самое можно сказать и про остальные атомы, значит эта реакция уравнена.
). То же самое можно сказать и про остальные атомы, значит эта реакция уравнена.
Таким образом, уравнивание – это расстановка коэффициентов для того, чтобы уравнять атомы до и после реакции (слева и справа).

В химии существуют два типа реакций:
Отличие заключается в том, что в ходе окислительно-восстановительной реакции происходит изменение степени окисления элементов, а в ходе реакций ионного обмена – нет.
В зависимости от того, какая перед нами реакция, методика уравнивания будет отличаться. Давай начнем с РИО.
Представь, что мы запускаем ракеты в космос. Примерно через 140 секунд часть наших ракет отсоединила от себя ступени, а часть в неразобранном виде полетела на Марс.

Подобно ракетам вещества делятся на электролиты и неэлектролиты:
Возникает вопрос: что такое ионы?
| Ион – атом или группа атомов, которая имеет электрический заряд. Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами. |
А теперь давай отвлечемся и представим, что мы попали в мир розовых и голубых монстров. Эти монстры всегда держатся за руки, соблюдая два строгих правила:
-
Розовый монстр держится за руки только с голубым;
-
Ни у одного монстра не должно остаться свободных рук.
Только есть одна особенность: у этих монстров разное количество рук: одна, две, три.

Эти монстры могут меняться парами, но оба правила всегда должны соблюдаться. Это и есть реакции ионного обмена.
| Реакции ионного обмена – реакции между ионами, образовавшимися в результате диссоциации (распада) электролитов. |
Ионы бывают однозарядными, двухзарядными и трехзарядными (подобно количеству рук у монстров).
Катионы
Однозарядные:  , одновалентные металлы (
, одновалентные металлы ( ), ион аммония (
), ион аммония ( )
)
Двухзарядные: двухвалентные металлы ( )
)
Трехзарядные: трехвалентные металлы ( )
)
Анионы
Однозарядные: 
Двухзарядные: 
Трехзарядные: 
Принцип уравнивания РИО сводится к тому, чтобы уравнять ионы до и после реакции (слева и справа).
Давай разберем это на примере реакции:

На языке монстров это будет выглядеть так:

Слева два хлора соединены с двухзарядным кальцием, а справа один хлор стоит в паре с однозарядным серебром.
Также нитрат-иона справа в два раза больше, чем слева.
Для того, чтобы уравнять реакцию, мы должны поставить коэффициент 2 перед  и
и  , тогда реакция будет выглядеть так:
, тогда реакция будет выглядеть так:

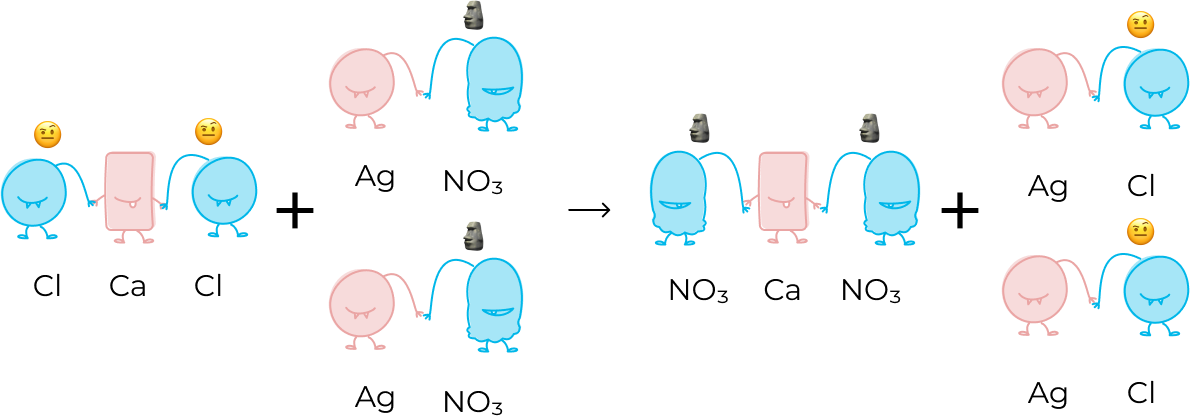
Таким образом, в этой статье мы научились уравнивать химические реакции. Надеемся, что материал был для тебя полезен, и ты обязательно будешь использовать его при решении задач на ЕГЭ. Желаем успехов!
Тест по теме “Как уравнивать реакции ионного обмена”
Разбор:
Набранные баллы:
5
Смотреть разбор
Отправить тест на проверку?
Ты решил еще не все задания
) и справа тоже 4 (
и
). То же самое можно сказать и про остальные атомы, значит эта реакция уравнена.