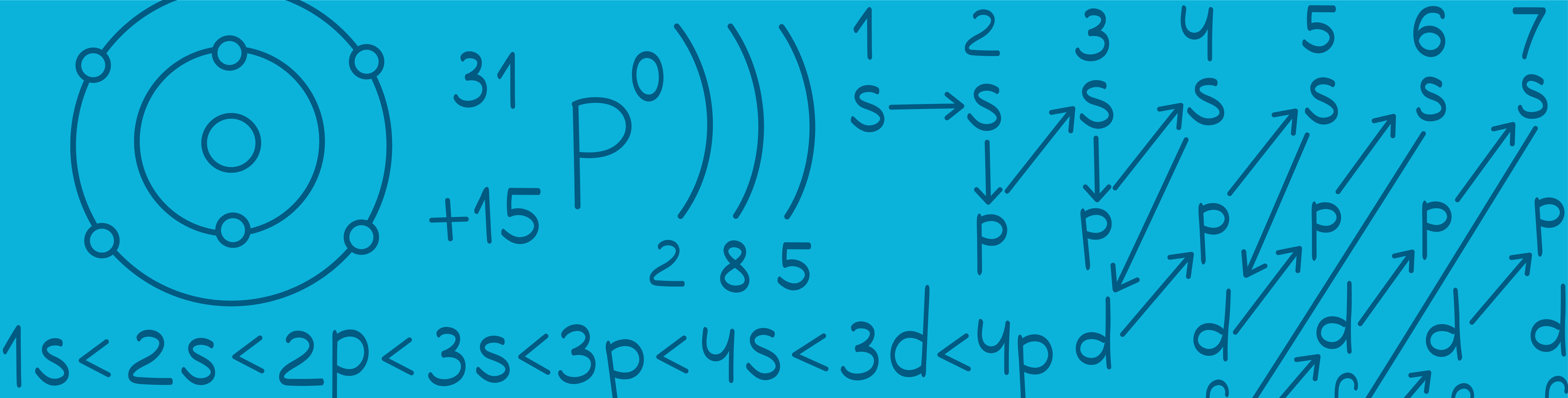Вокруг ядра атома находятся электроны.
|
Электрон – частица, которая имеет заряд «-1» и очень маленькую массу, которой, как правило, пренебрегают. Электронная оболочка атома – совокупность всех электронов данного элемента. |
Поскольку атом не имеет заряда, количество «+» частиц должно быть равно количеству «-» частиц, поэтому в атоме:
| Количество электронов = количеству протонов = порядковому номеру элемента. |
Электроны удерживаются ядром за счет электростатического притяжения. Но все они находятся на разном расстоянии от ядра. Кто-то – ближе, а кто-то – дальше. Все зависит от энергии электронов.
Электроны с меньшей энергией находятся ближе всех к ядру. Чем больше энергия электрона, тем сильнее он удаляется от ядра.
Электроны с одинаковой энергией, соответственно, находятся на одинаковом расстоянии от ядра и образуют энергетический уровень (электронный слой).
Количество энергетических уровней у любого элемента равно номеру периода в таблице Менделеева.
Самый дальний от ядра уровень называется внешним. Его номер равен номеру периода, а электроны на нем называются внешними электронами. Перед внешним уровнем находится предвнешний.
На одном уровне находятся несколько электронов с одинаковой энергией. Но дело в том, что они движутся вокруг ядра по разным траекториям и в разных плоскостях.
Эти траектории называются орбиталями.
Их существует несколько типов:
--орбиталь
--орбиталь
--орбиталь
--орбиталь
Рассмотрим каждую орбиталь:
-орбиталь имеет форму шара, который во всех плоскостях существует в неизменном виде.
-орбиталь имеет форму гантелей и может существовать в трёх взаимно перпендикулярных плоскостях.
Орбитали и
имеют не постоянную форму, однако известно, что
-орбиталь имеет пять вариантов, а
-орбиталь – семь.
Таким образом, мы имеем: уровни, в каждом из которых есть орбитали, существующие в разных плоскостях.
Совокупность одинаковых орбиталей одного уровня называется подуровень. Например, все -орбитали (в количестве трёх) 2-го уровня образуют
-подуровень.
Запоминаем: чем ближе уровень к ядру, тем меньше электронов и орбиталей он в себя вмещает.
Оказалось, что 1 энергетический уровень состоит только из одного -подуровня. На 2 энергетическом уровне находятся
и
подуровни, на третьем –
подуровни.