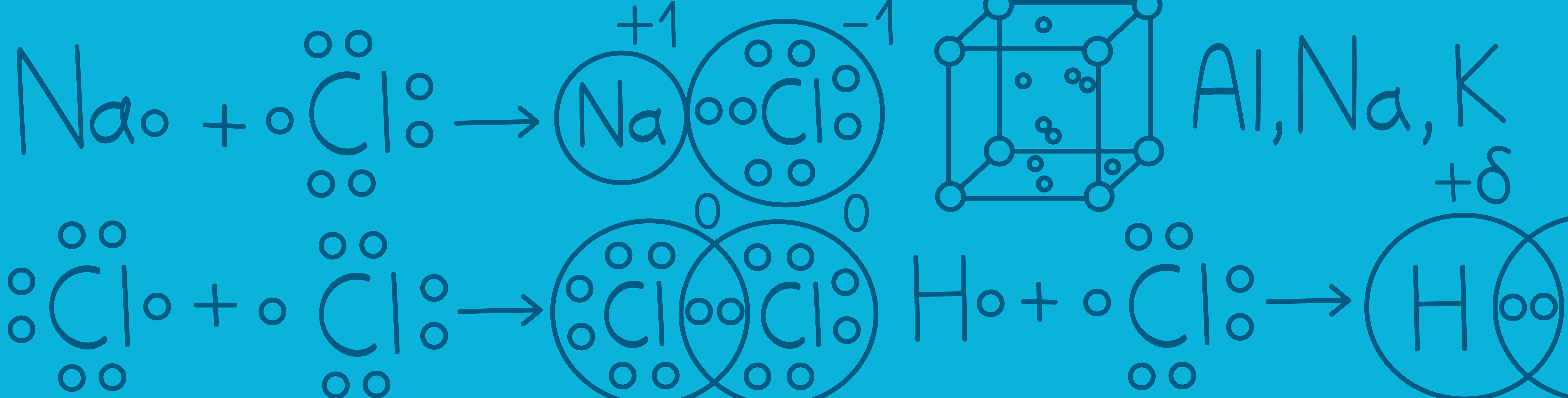
Итак, все вокруг состоит из атомов. Атомы взаимодействуют друг с другом посредством образования химических связей (электронной пары). Давайте подробнее разберем виды связи и механизм их образования.
Все элементы в таблице Менделеева можно разделить на металлы и неметаллы. Атомы отличаются друг от друга электроотрицательностью – способностью атомов перетягивать на себя общую электронную пару. У неметаллов электроотрицательность выше, самый ЭО элемент – это фтор.
Таким образом, когда образуется соединение из нескольких атомов, кто-то перетягивает электронную пару на себя сильнее.
При образовании соединения возможны несколько вариантов взаимодействия:
- Неметалл₁ + неметалл₂ (
 )
)
- Неметалл₁ + неметалл₁ (
 )
)
- Металл + неметалл (
 )
)
- Металл₁ + металл₁ (
 )
)

Ковалентная связь: полярная и неполярная
- Если связь возникает между двумя неметаллами, то такая связь будет называться ковалентной.
- Если связь возникает между двумя одинаковыми неметаллами, то электронная пара никуда не смещается, а связь называется ковалентной неполярной.
Примеры: 

 и так далее.
и так далее.
Если связь образуется между двумя разными неметаллами, то электронная пара уже будет смещаться к более электроотрицательному элементу. Такая связь будет иметь название ковалентной полярной.
Примеры: 


Коротко о главном: основными характеристиками ковалентной связи являются: полярность, энергия, длина, кратность, направленность, насыщаемость.

Ионная связь
Ковалентная связь образуется между атомами с небольшой разницей в электроотрицательности. При этом электронная пара либо не смещается (ковалентная неполярная), либо смещается незначительно (ковалентная полярная).
Однако если разница в электроотрицательности значительная, что бывает тогда, когда металл (или ион аммония  ) сталкиваются с неметаллом (кислотным остатком), общая электронная пара не просто смещается к более электроотрицательному атому, она полностью переходит к нему. При этом образуются два иона (заряженные частицы):
) сталкиваются с неметаллом (кислотным остатком), общая электронная пара не просто смещается к более электроотрицательному атому, она полностью переходит к нему. При этом образуются два иона (заряженные частицы):
- Металл, от которого его электрон улетел, становится катионом (положительно заряженным ионом).
- Неметалл, который забрал лишний электрон, становится анионом (отрицательно заряженным ионом).
Поэтому такая связь будет называться ионной.
Примеры: 


Металлическая связь
И остался последний вариант связи: металлическая.
Примеры: 


Эта связь образуется за счёт свободных ионов в кристаллической решетке металла.
Тест по теме “Типы химической связи”
Разбор:
Набранные баллы:
5
Смотреть разбор
Отправить тест на проверку?
Ты решил еще не все задания