
Наш мир так многообразен, потому что химические элементы способны образовывать соединения посредством связей. В свою очередь химия связь зависит от степени валентности. Поэтому разбираемся, что это и как поможет нам на экзамене.
| Валентность — это возможность атомов образовывать химические связи с другими атомами. Она обозначается римскими цифрами (I, II, III, IV и т.д.) |
Есть элементы, у которых только одна валентность. Например, Кальций: его постоянная валентность, равная II, а это значит, что он может образовывать две связи: 
Но большинство элементов в разных соединениях проявляют разную валентность. Например, сера. У нее может быть валентность II, IV, VI: 
В таком случае различают низшую валентность ― минимальное число связей, которые может образовать элемент, промежуточную, и высшую (максимальное число связей). Для серы минимальная валентность – II, максимальная - VI.
Как же определить, у каких элементов постоянная валентность, а у каких – переменная?
Для этого есть таблица, в которой собраны все элементы с постоянной валентностью, у всех остальных – переменная.
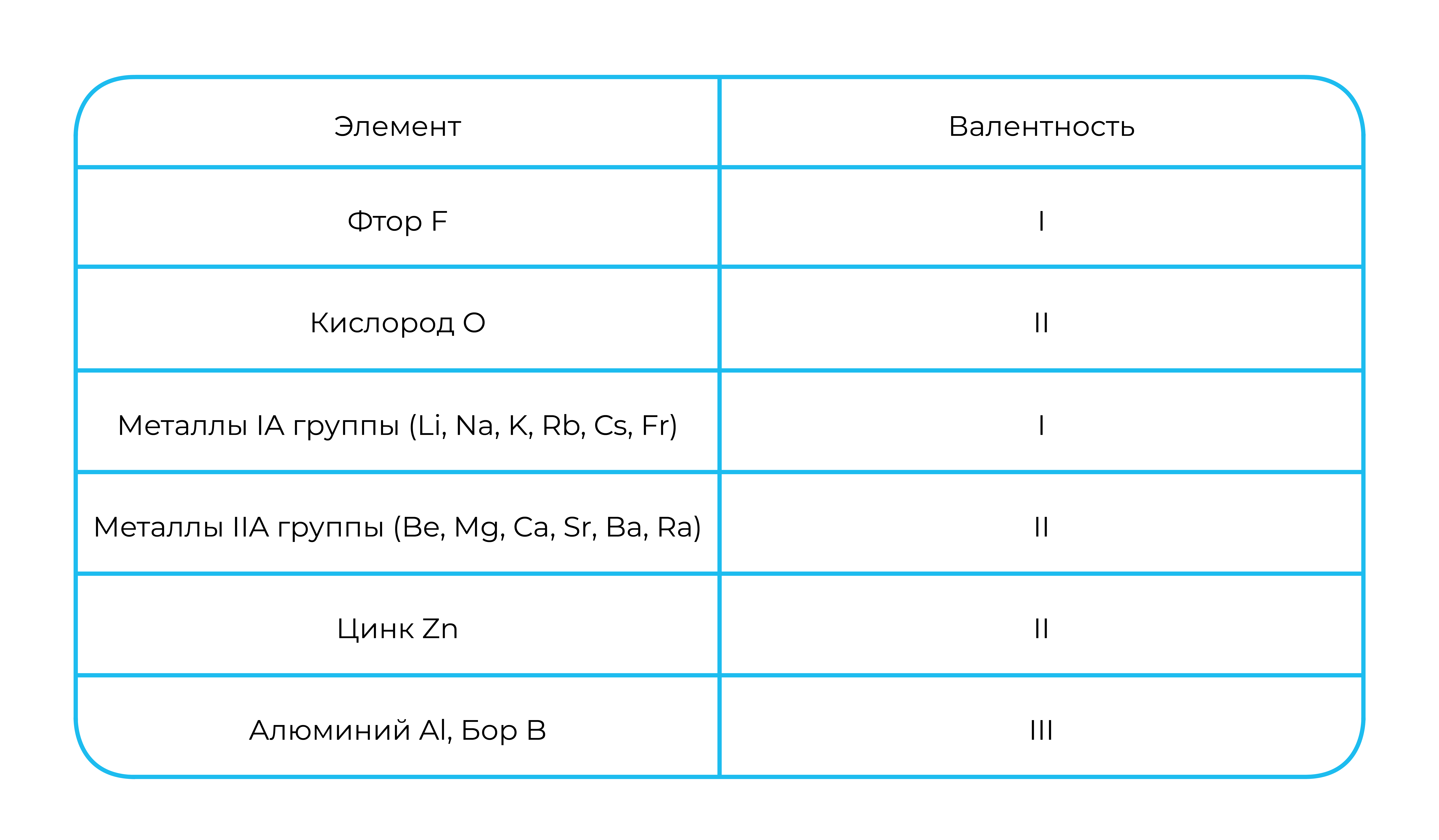
Теперь разбираемся с элементами, у которых может быть несколько валентностей:
Для этих элементов (за исключением кислорода, азота и фтора (см. тему "Возбужденное состояние") высшая валентность равна номеру группы.
Низшая валентность вычисляется по формуле: № группы – 8
Валентность между высшей и низшей называется промежуточной.
Разберем на примере брома:
- Бром находится в VII группе, значит его высшая валентность равна VII.
- Считаем низшую валентность: № группы – 8 = 7 – 8 = –1. Валентность – это количество связей, поэтому она не может быть отрицательной, соответственно низшая валентность брома равна I. Промежуточная валентность брома – III, V (см. тему «Возбужденное состояние»).

Механизмы образования химических связей
Но как образуются связи? Что такого происходит между атомами, что они соединяются в молекулы?
Существуют два механизма образования этих связей:
- Обменный;
- Донорно-акцепторный.
В основном все атомы используют обменный механизм. Для этого каждый из них предоставляет по одному неспаренному электрону для образования электронной пары. В образовании связи участвуют валентные электроны.
Валентные электроны для элементов главной подгруппы – это внешние электроны (на внешнем уровне), их количество равно номеру группы, в которой находится элемент. Например, у алюминия их 3 (потому что он находится в 3 группе, значит на внешнем уровне у него 3 электрона).

Для элементов побочной подгруппы – это электроны на внешнем уровне + d-подуровне предвнешнего. Например, у титана, электронная конфигурация которого выглядит так: Ti 1s²2s²2p⁶3s²3p⁶4s²3d², валентными электронами будут 2 электрона на 4 уровне и 2 на d-подуровне 3-го уровня, итого 4 валентных электрона.
Неспаренные электроны образуются путем распаривания электронных пар на внешнем энергетическом уровне (см. тему «Возбужденное состояние»).
У азота N, кислорода O и фтора F такой возможности нет, поэтому их высшая валентность не равна номеру группы.Очень редко элементы используют донорно-акцепторный механизм. Об этом мы поговорим в следующей статье
Пример задания
Посмотрим примерное задание:
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут иметь валентность V.
1) N
2) F
3) B
4) As
5) P
Ответ: 45
Решение:
- У фтора F постоянная валентность (из таблицы) равна I
- У бора B постоянная валентность (из таблицы) равна III
Азот N, мышьяк As и фосфор P находятся в 5 группе, значит их валентность может быть равна V. Однако азот N ― исключение, его высшая валентность не может быть равна номеру группы (V).
Помни, что большинство химических элементов обладают переменной валентностью, которую можно определить по таблице Менделеева, где номер группы соответствует высшей валентности элемента. Если от восьми отнять номер группы, где находится элемент, мы узнаем его низшую валентность.
Тест по теме “Валентность”
Разбор:
Набранные баллы:
5
Смотреть разбор
Отправить тест на проверку?
Ты решил еще не все задания














