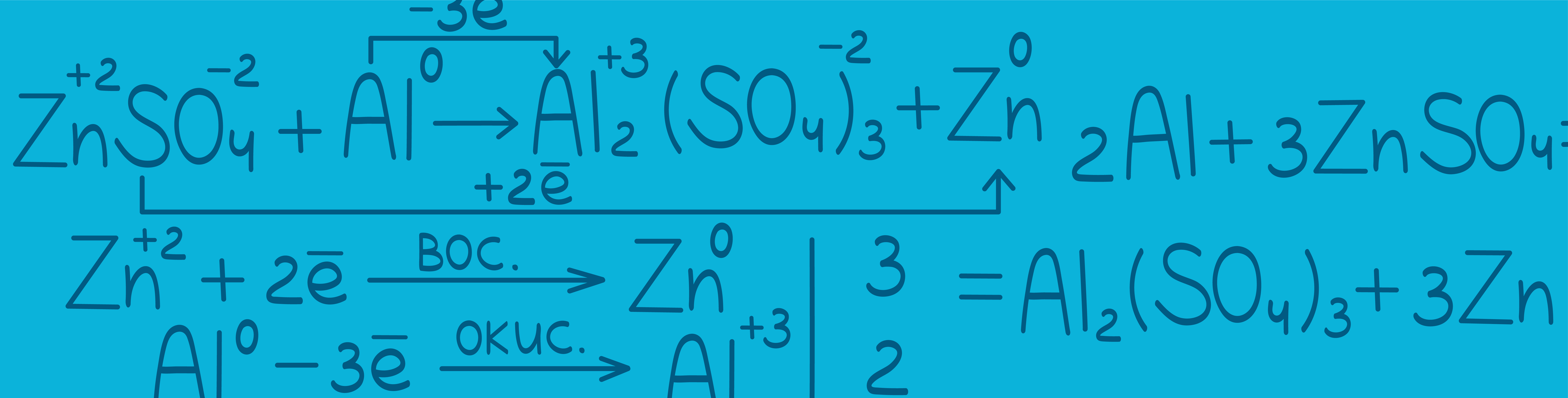Суть окислительно-восстановительной реакции заключается в обмене электронами: одни элементы их отдают, а другие — забирают, в результате чего и происходит изменение степени окисления этих элементов и образуются новые вещества.
| Элемент, который отдает электроны, называется восстановителем, а элемент, который эти электроны принимает — окислителем. |
Чтобы проще это было запомнить, предлагаю твоему вниманию такой интересный стишок:
Окислитель — он грабитель. Электроны отбирает, карму (степень окисления) резко понижает. Восстановитель — он спаситель. Электроны отдает, карма (степень окисления) вверх его растет.

Итак, мы делаем первый важный вывод: ОВР — это реакция между окислителем и восстановителем.
Составление ОВР происходит в 3 этапа:
-
выбор реагентов: окислителя, восстановителя и среды, если она необходима;
-
написание продуктов реакции;
-
расставление коэффициентов (уравнивание).


Выбор реагентов
Окислитель — это грабитель. Раз он отбирает электроны, значит у него их либо нет, либо мало.
Окислителями могут быть:
-
Простые вещества — неметаллы с высокой электроотрицательностью (




 );
);
-
Элементы в высшей степени окисления:
-
Элементы в промежуточной степени окисления:
Кто может быть восстановителем?
Восстановитель — это спаситель. Раз он отдает электроны, значит у него их очень много.
Восстановителями могут быть:
-
Простые вещества — металлы (
 и т.д.)
и т.д.)
-
Простые вещества — неметаллы с невысокой электроотрицатетельностью (



 — только с некоторыми окислителями);
— только с некоторыми окислителями);
-
Элементы в низшей степени окисления:
-
Элементы в промежуточной степени окисления:
Кто может быть средой?
Среда — это третий реагент, который необязательно будет присутствовать в реакции. Среда может быть кислой, щелочной и нейтральной (водной).
-
В качестве кислой среды может выступать только сильная кислота 
-
Присутствие щёлочи формирует щелочную среду 
-
Во всех остальных случаях мы будем считать, что среда нейтральная.
Зачем нужна среда?
-
Сила некоторых окислителей будет от нее зависеть. Например,  в
в  в кислой среде заберет 5 электронов, в нейтральной - 3 электрона, а в щелочной - 1.
в кислой среде заберет 5 электронов, в нейтральной - 3 электрона, а в щелочной - 1.
-
Среда влияет на продукты реакции. Например, образовавшийся  в щелочной среде выделится в виде
в щелочной среде выделится в виде  а в сернокислой среде
а в сернокислой среде  с
с  будут реагировать с образованием
будут реагировать с образованием 
Второй важный вывод: окислителем и восстановителем могут быть только определенные вещества, перечень которых нужно запомнить.
Итак, теперь мы знаем, какие реагенты могут участвовать в ОВР. Осталось научиться писать продукты.
Написание продуктов
Продукты реакции складываются из:
-
того, во что превратился окислитель
-
того, во что превратился восстановитель
-
побочных продуктов
Куда превращаются окислители:

Куда превращаются восстановители:

Пользуясь этой схемой ты сможешь предугадывать основные продукты окислительно-восстановительных реакций.
Как написать побочные продукты?
Как видно из примеров в таблице, помимо веществ, в которые превратились окислитель и восстановитель, в продуктах могут присутствовать дополнительные вещества. Их называют побочные продукты.

Нет определенного правила, по которому можно было предугадать любой побочный продукт, однако есть некоторые принципы, которые помогут их предположить:
-
В побочных продуктах находятся элементы, которые не были задействованы в основных продуктах:
Например, в реакции  сульфат калия - это побочный продукт, так как KMnO₄ превратился в
сульфат калия - это побочный продукт, так как KMnO₄ превратился в  лишившись калия.
лишившись калия.
-
Среда влияет и на побочные продукты тоже: в кислой среде образуются соли металлов:
Например, в реакции  перед нами тоже стояла задача выделить калий в продуктах, однако среда раствора была нейтральной, поэтому соль выделить мы не можем.
перед нами тоже стояла задача выделить калий в продуктах, однако среда раствора была нейтральной, поэтому соль выделить мы не можем.
-
Некоторые побочные продукты появляются после уравнивания. После составления метода электронного баланса и расстановки коэффициентов, может выяснится, что каких-то элементов не хватает для уравнивания. Так часто бывает с водой, которую мы почти всегда можем добавить как в левую, так и в правую часть уравнения реакции, ведь большинство ОВР протекают в растворе.
Уравнивание
После написания продуктов реакции, мы приступаем к уравниванию.
| Уравнивание — это расстановка коэффициентов для того, чтобы уравнять атомы до и после реакции (слева и справа). |
Пример:
Составьте уравнение реакции: 
1 ЭТАП: разберемся в реагентах
2 ЭТАП: предположим продукты реакции:
Итоговая схема реакции: 
3 ЭТАП: уравняем реакцию
Для расчёта коэффициентов составим электронный баланс между окислителем и восстановителем: 
Чтобы уравнять фосфор и марганец, перед фосфором слева и справа поставим  а перед марганцем —
а перед марганцем — 

Для того чтобы уравнять  атомов
атомов  в правую часть надо добавить
в правую часть надо добавить 

Теперь в правой части  атомов
атомов 
 в составе
в составе  и
и  в составе
в составе  Чтобы уравнять серу, в левую часть добавляем
Чтобы уравнять серу, в левую часть добавляем 

Наконец, число атомов кислорода и водорода уравнивается добавлением в правую часть  молекул
молекул 

Тест по теме “Окислительно-восстановительные реакции”
Разбор:
Набранные баллы:
5
Смотреть разбор
Отправить тест на проверку?
Ты решил еще не все задания