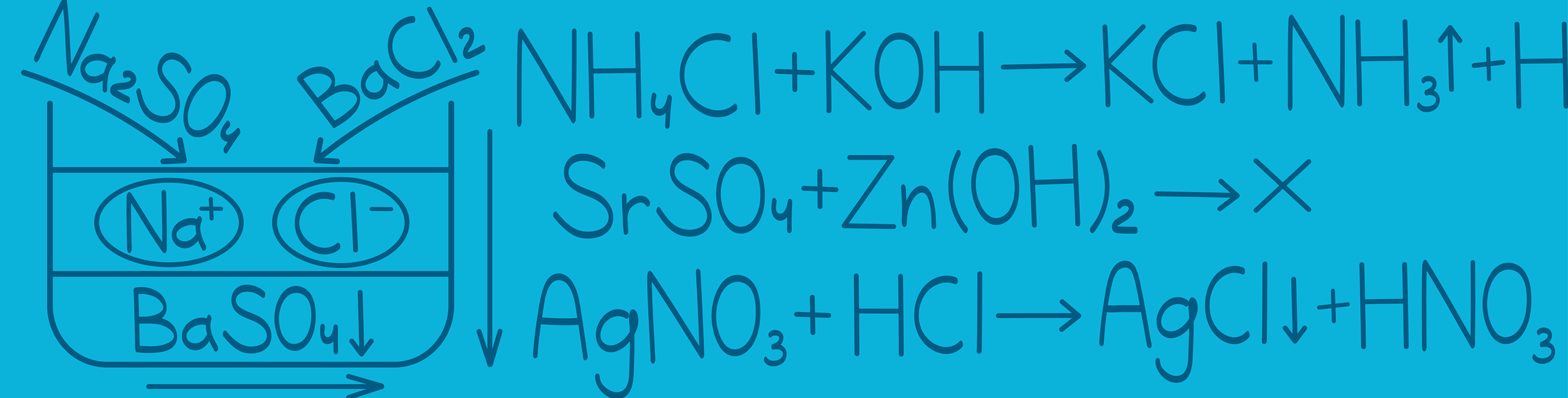|
Электролиты — это вещества, которые распадаются на ионы в растворе или расплаве.
Неэлектролиты — это вещества, которые на ионы не распадаются.
|
Например, если мы поместим в раствор сильный электролит — хлорид натрия, он распадается на ионы натрия и ионы хлора, которые теперь уже будут плавать отдельно.
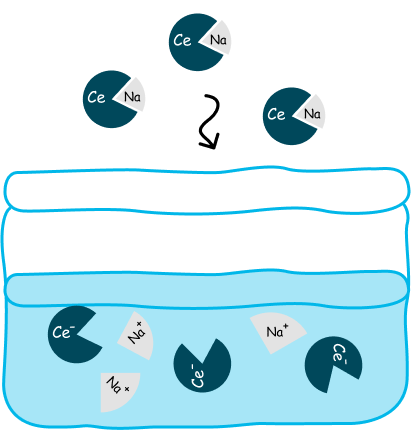
Сильный электролит  распался на ионы в растворе.
распался на ионы в растворе.
Если следом мы добавим в этот раствор другой сильный электролит — нитрат серебра, ионы двух солей будут взаимодействовать друг с другом, образуя две новые соли:
-
нитрат натрия: сильный электролит и распадается на ионы;
-
хлорид серебра: неэлектролит и на ионы не распадается, образуя целую молекулу.
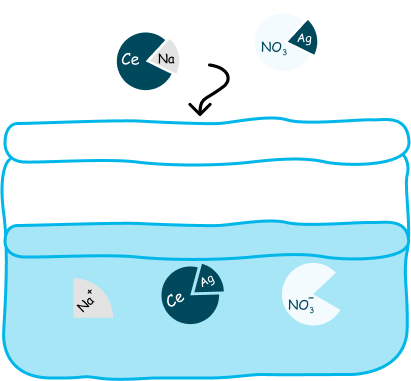
В результате РИО образовался неэлектролит — соль 
Только что мы с тобой описали классическую реакцию ионного обмена, а теперь давай разбираться подробнее.

Составление РИО
Чтобы научиться писать реакцию ионного обмена, нам нужно будет последовательно пройти три этапа:
-
изучить классификацию неорганических веществ;
-
изучить четыре варианта РИО;
-
научиться составлять реакции полного ионного и сокращенного ионного уравнения.
1 этап
Основные классы, которые нас будут интересовать в этой теме — это основания и кислоты.
В неорганической химии кислоты и основания делятся на сильные и слабые. Силу знать необходимо для того, чтобы уметь составлять уравнения реакций.
К сильным основаниям относятся растворимые и малорастворимые основания щелочных и щелочноземельных металлов (щелочи):   и т.д. Соответственно нерастворимые основания и раствор аммиака мы отнесем к слабым основаниям: и т.д. Соответственно нерастворимые основания и раствор аммиака мы отнесем к слабым основаниям:   и т.д. и т.д. |
Кислоты, как известно, делятся на кислородсодержащие и бескислородные. Принцип определения силы кислоты зависит от того, есть в ней кислород или нет.
Для кислородсодержащей кислоты мы используем правило Полинга: если при вычитании из индекса кислорода индекса водорода мы получаем 0 или 1, то это кислота слабая: 


 а если получаем
а если получаем  или
или  то кислота сильная:
то кислота сильная: 



Для определения силы бескислородной кислоты смотрим на ее состав.

Теперь, зная классификацию в неорганике, мы можем приступить к составлению уравнения реакции ионного обмена. На наше счастье таких реакций всего лишь четыре варианта.
2 этап
-
Кислота + основание = соль + вода
Условия: в реагентах сильное основание и/или сильная кислота.
Примеры:

-
Кислота + соль = другая кислота + другая соль
Условия: ЛИБО образуется соль, нерастворимая в кислотах, ЛИБО сильная кислота вытесняет слабую.
Соли, нерастворимые в кислотах: 







Примеры:

-
Соль + основание = другая соль + другое основание
Условия: оба реагента растворимые И в результате получается осадок или газ или вода. Обрати внимание: соблюдаться должны оба условия.
Примеры:

-
Соль + соль = другая соль + другая соль
Условия: оба растворимые И в результате осадок. Обрати внимание: соблюдаться должны оба условия.
Примеры:

Теперь ты знаешь все правила для того, чтобы составлять РИО. Этого достаточно, чтобы решать многие задания в ЕГЭ по химии. Однако для того, чтобы решить задание №30, посвященное РИО, нужно уметь составлять также полное и сокращенное ионное уравнения.
3 этап
В полном ионном уравнении мы расписываем электролиты на ионы, а неэлектролиты оставляем в виде молекул. В сокращенном ионном уравнении мы сокращаем ионы, которые повторяются слева и справа в уравнении реакции.
На ионы мы будем расписывать только сильные электролиты.
К сильным электролитам относятся сильные основания (щёлочи), сильные кислоты и растворимые соли. Все остальные вещества относятся либо к неэлектролитам, либо к слабым электролитам, поэтому на ионы мы их расписывать не будем.
Сильные кислоты: 







Щелочи: растворимые и малорастворимые основания металлов


Растворимые соли: P в таблице растворимости


Осадки
Газы: 
 ,
, 

Слабые электролиты: слабые кислоты (в т.ч. органические), воды, гидроксид аммония
Примеры:









Тест по теме “Реакции ионного обмена”
Разбор:
Набранные баллы:
5
Смотреть разбор
Отправить тест на проверку?
Ты решил еще не все задания
распался на ионы в растворе.