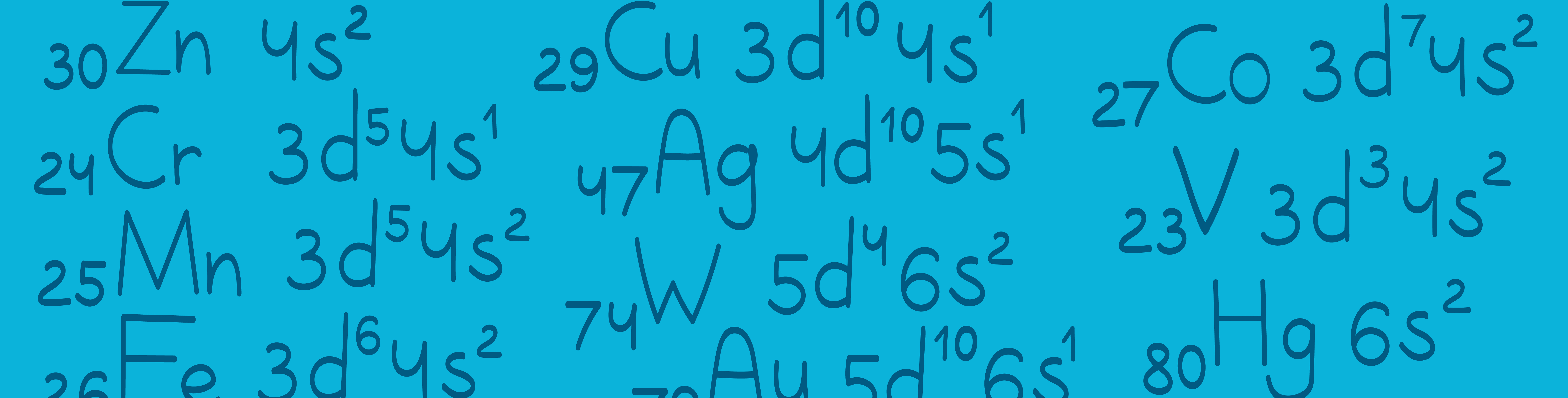Есть несколько элементов, электронная конфигурация которых отличается от общепринятой. В 1 задании иногда попадаются эти элементы, давайте разберем их особенности:
Вспомним основные тезисы по теме "конфигурация атома":
- Электроны располагаются вокруг ядра уровнями.
- Количество уровней равно номеру периода.
- Период – это горизонтальный столбец.
- Внутри каждого уровня есть подуровни, которые называются орбиталями.
- На первом уровне только
-орбиталь. На втором –
и
на третьем –
,
,
- Группа – это вертикальный ряд химических элементов.
- Она делится на главную и побочную подгруппы. Главная подгруппа начинается сверху, а побочная располагается с другого края группы.
И вот тут возникает вопрос: чем отличаются элементы главной и побочной подгруппы, почему одни находятся справа, а другие – слева?
Давайте рассмотрим электронную конфигурацию титана:
Порядковый номер этого элемента – 22, значит у него 22 электрона. И теперь заполняем энергетические уровни согласно принципу наименьшей энергии:
Далее рассмотрим, как заполняются эти уровни в таблице Менделеева:
У Титана электронная конфигурация заканчивается на -подуровне, поэтому в таблице Менделеева он находится в побочной подгруппе и называется переходным элементом. Можем сделать вывод: