Для того, чтобы решить задание №3, нам нужно разбираться в понятиях «валентность», «степень окисления», и не путать их. Итак, начнем с самого начала:
Связь между атомами образуется за счет образования общей электронной пары. Электроны имеют отрицательный заряд.
Все элементы в таблице Менделеева имеют разную электроотрицательность (способность притягивать электроны). Когда образуется связь, какой-то из элементов сильнее притягивает электрон (несколько электронов), и его заряд становится отрицательным. А у атома, от которого этот электрон улетает, заряд становится положительным.
Например, NaCl: у хлора электроотрицательность больше, чем у натрия, поэтому он перетягивает электрон натрия и приобретает отрицательный заряд, а натрий – положительный.
| Степень окисления — это условный заряд атома элемента в соединении. |
Она обозначается латинскими цифрами и всегда имеет знак (+2, -3, +7). При этом очень важно сначала ставить знак, а потом цифру, например, .
Как и с валентностью, есть элементы с постоянной степенью окисления, а есть с переменной. Мы также должны запомнить список первых, хотя он и становится немного шире:
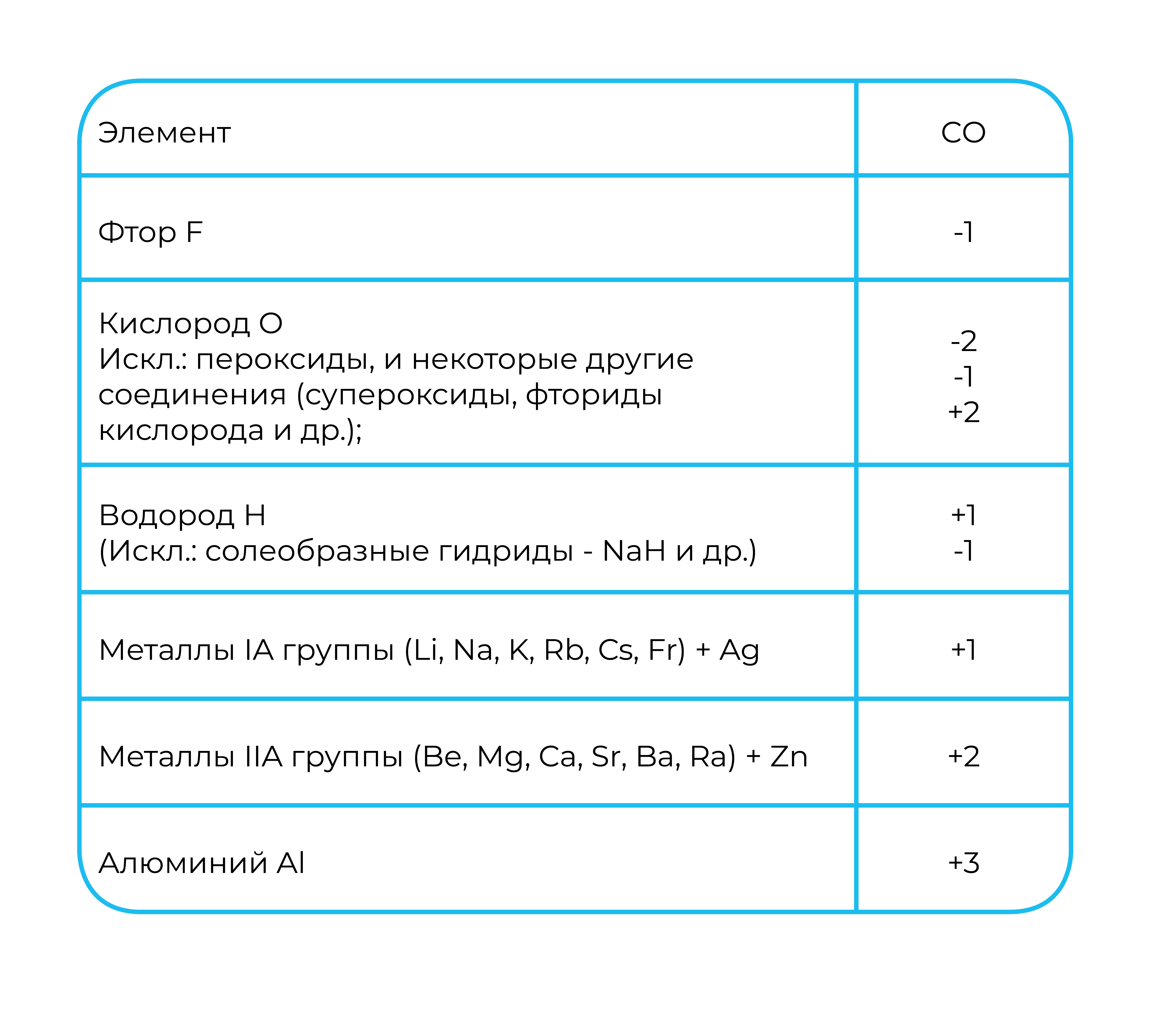
Как и валентность, степень окисления бывает высшая, низшая и промежуточная. Высшая степень окисления равна номеру группы со знаком «плюс». Низшая определяется по формуле: № группы – 8. И промежуточная степень окисления — это все, что между ними.
С первого взгляда может показаться, что валентность и степень окисления целочисленно равны. Например, Na: валентность – I, степень окисления – +1.
Но степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе равна I, а степень окисления – 0.
В двойных оксидах у атома две степени окисления. Например, в железной окалине у железа две степени окисления: +2 и +3..
В пероксидах степень окисления атомов кислорода, равна –1, а валентность – 2. ().