Газообразное состояние вещества является самым простым для изучения. В разреженных газах расстояния между молекулами достаточно большое и их взаимодействием можно пренебречь. Для описания разреженных газов в физике используют модель идеального газа.
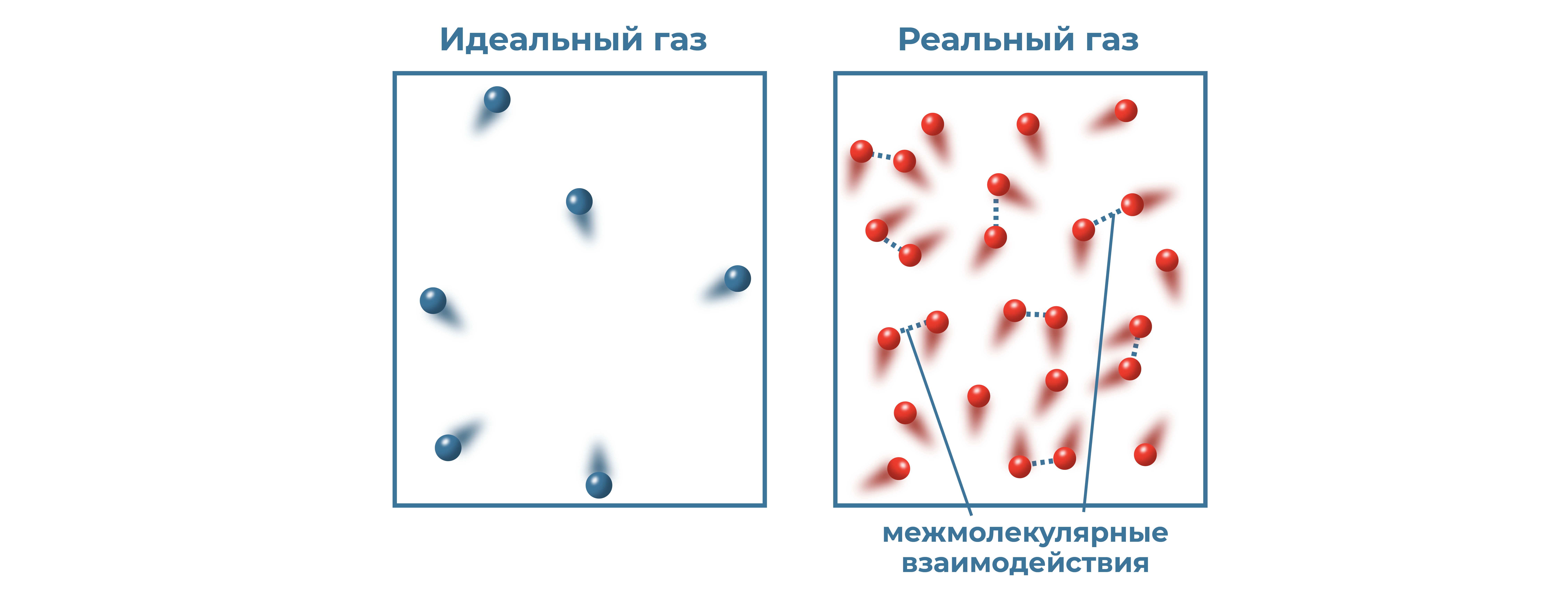
Идеальный газ должен удовлетворять следующим требованиям:
- Молекулы – материальные точки,
- Потенциальной энергией взаимодействия можно пренебречь,
- Столкновения между молекулами являются абсолютно упругими.
Идеальный газ – это газ, состоящий из материальных точек, которые не взаимодействуют между собой и испытывают абсолютно упругое соударение со стенками сосуда.
Средняя кинетическая энергия идеального газа
Ключевую роль в описании модели идеального газа играет средняя кинетическая энергия идеального газа. Идеальный газ состоит из материальных точек, и кинетическая энергия для частиц газа запишется в виде:
Причем у каждой частицы своя скорость и своя кинетическая энергия. Пусть в газе содержится N молекул, которые имеют скорости:
Тогда каждая частица имеет кинетическую энергию. А средняя кинетическая энергия идеального газа – это среднее арифметическое кинетических энергий молекул газа:
Последний множитель – средний квадрат скорости. А корень из него называется среднеквадратичной скоростью.
В таком случае среднюю кинетическую энергию идеального газа можно записать в виде:
Давление идеального газа
Давление идеального газа получается из-за ударов молекул о стенки сосуда. Вспомним, что в модели идеального газа, столкновения молекул считаются абсолютно упругими, и при ударе молекулы о стенку сосуда у нее изменяется импульс. По закону сохранения импульса такой же импульс передается стенке.
Начнем с одной молекулы: пусть у нас имеются кубический сосуд с длиной ребра и одна молекула внутри куба с массой
.
До удара об стенку у молекулы был импульс , после абсолютно упругого удара импульс изменился на противоположный:
. Тогда стенке передается импульс
. Время, через которое молекула второй раз сталкивается с той же стенкой:
.
Следовательно, сила действия молекулы на эту стенку будет равна:
Давление равно отношению силы на площадь:
Подставив, получаем:
Причем произведение площади на длину
есть объем
.
При этом давление во всех направлениях будет находиться похожим образом:
Полная скорость молекулы будет равна:
Поскольку все направления движения молекулы равновероятны, то можно записать следующее:
Давление газа во все стороны равны, тогда:
Такое давление будет создаваться одной молекулой, но в сосуде как правило молекул много, и тогда давление для молекул будет в
раз больше:
Причем:
И можно переписать формулу для давления в более простом виде:
Эта формула называется основным уравнением МКТ.
Оно связывает макроскопические параметры (давление, объем, температуру) системы с микроскопическими параметрами (среднеквадратичной скоростью, массой молекул).
В данной статье мы разобрали с вами тему идеального газа в молекулярной физики. Она будет очень часто встречаться в заданиях на молекулярную физику и термодинамику. А фундаментальные знания помогут проще разобраться в более сложных законах и физических закономерностях.













